Grafite, formula molekulari: C, pisu molekulari: 12.01, hè una forma di l'elementu di carbone, ogni atomu di carbone hè cunnessu da trè altri atomi di carbonu (disposti in esagoni di favo) per furmà una molècula covalente. Perchè ogni atomu di carbone emette un iltronu, quelli chì ponu spustà liberamente, cusì u grafitu hè un cunduttore.
U grafite hè unu di i minerali più morbidi, è i so usi includenu a fabricazione di lapis è lubricanti. U carbone hè un elementu micca metallicu situatu in u gruppu IVA di u secondu ciculu di a tavola periodica. U grafite hè furmatu à alta temperatura.
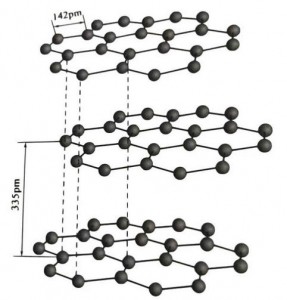
U grafite hè un minerale cristallinu di elementi di carbone, è a so reticula cristallina hè una struttura di strati esagonali. A distanza trà ogni strata di maglia hè 3.35A, è a spaziatura di l'atomi di carbone in a stessa capa di maglia hè 1.42A. Hè un sistema di cristalli esagonale cù un clivage in strati cumpletu. A superficia di cleavage hè principarmenti ligami moleculari, menu attrattivi per e molécule, cusì u so float naturali hè assai bonu.
In i cristalli di grafite, l'atomi di carbone in a listessa capa formanu un ligame covalente cù l'hibridazione sp2, è ogni atomu di carbone hè cunnessu cù trè altri atomi in trè ligami covalenti. I sei atomi di carbone formanu un anellu di sei cuntinui in u stessu pianu, chì si estende in una struttura di lamella, induve a lunghezza di u ligame di u ligame CC hè 142 pm, chì hè esattamente in u intervallu di lunghezza di u ligame di u cristallu atomicu, cusì per a stessa capa. , hè un cristallu atomicu. L'atomi di carbone in u stessu pianu anu una orbita p, chì si sovrapponenu. L'elettroni sò relativamente liberi, equivalenti à l'elettroni liberi in metalli, cusì u grafitu pò cunduce u calore è l'electricità, chì hè a caratteristica di i cristalli di metalli. Cusì ancu classificatu cum'è cristalli metallichi.
A capa media di u cristallu di grafite hè siparata da 335 pm, è a distanza hè grande. Hè cumminatu cù a forza di van der Waals, vale à dì, a capa appartene à u cristallu moleculare. In ogni casu, perchè u ligame di l'atomi di carbone in u stessu pianu pianu hè assai forte è estremamente difficiuli di distrughje, u puntu di dissoluzione di grafite hè ancu assai altu è e so proprietà chimiche sò stabili.
In vista di u so modu di ligame speciale, ùn pò micca esse cunsideratu cum'è un cristallu unicu o un policristallu, u grafite hè oghji generalmente cunsideratu cum'è un cristallu mistu.
Tempu di post: Jul-31-2023